Fala Gás Nobre, hoje vamos falar um pouco sobre os conceitos de número de mol e de massa molar, ambos muito presentes no dia a dia de qualquer laboratório de química.
Presentes no nosso cotidiano também, apesar de não os utilizarmos de maneira propriamente dita, porque seria meio estranho dizer que acabei de beber 10 mols de água ou invés de um copo, não?
Gás Nobre, antes de falarmos de número de mol e de massa molar, precisamos conceituar algumas coisas.
O conceito de átomo é muito antigo, sendo citado pela primeira vez por Demócrito, poeta grego que viveu entre 460a.C. e 370a.C., no entanto, uma concepção científica do mesmo foi dada apenas por John Dalton, físico e químico inglês, em um manuscrito datado de 6 de setembro de 1808.
O conceito de átomo, vem do grego ‘a’-sem e ‘tomo’-divisão, ou seja, o átomo seria a menor parte da matéria, indivisível. Hoje em dia são conhecidas partículas menores que os átomos, chamadas de subatômicas, como os prótons, nêutrons e elétrons, no entanto, manteve-se a nomenclatura ‘átomo’ devido a sua importância histórica e ser amplamente utilizada no mundo inteiro.
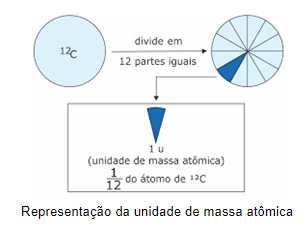
Os átomos constituem a matéria e suas transformações são o objeto de estudo dos químicos, ou seja, fazia-se necessário a padronização de uma unidade para definir a massa de um átomo.
Foi escolhido então o isótopo de carbono 12 como padrão, dividiu-se em 12 fatias e a 1 destas fatias atribui-se o valor de 1u, ou seja, 1 unidade de massa atômica. A unidade de massa atômica é então representada por ‘1u’ e representa 1/12 da massa atômica do isótopo de carbono 12.
A massa atômica os elementos é dada então por quantas unidades de massa atômica o formam, por exemplo, o flúor possui massa atômica igual a 19u, o carbono igual a 12u, o oxigênio igual a 16u, assim por diante.
Já a massa molecular, é dada pela soma das massas atômicas dos átomos que constituem a molécula, por exemplo, a massa molecular da água é dada pela soma das massas atômicas dos 2 hidrogênios e do oxigênio que a formam. Sendo também representada por ‘u’ (unidade de massa atômica).
Massa molecular H2O = (2x massa atômica do hidrogênio) + massa atômica do oxigênio
Massa molecular H2O = (2x 1u) + 16u
Massa molecular H2O = 18u
Leia mais em: Estudo de moléculas: Um resumo completo
No entanto, átomos e moléculas são partículas muito pequenas, fazia-se necessário determinar uma quantidade específica de matéria que representasse uma porção representativa de átomos. A esta quantidade, foi atribuída o termo ‘mol’, que do latim significa amontoado ou monte, e definiu-se que este amontoado de coisas teria a massa em gramas igual ao valor da massa atômica/molecular.
Definiu-se que “mol é a quantidade de matéria de um sistema que contém tantas entidades elementares quanto o número de átomos contidos em 12g gramas de carbono-12”.
Por exemplo, definiu-se que 1 mol de água teria 18g, ou seja, a massa equivalente em gramas da massa molecular (18u), sendo assim sucessivamente para os demais átomos e moléculas.
Definiu-se assim a massa molecular, que é a massa em gramas de 1 mol de qualquer elemento ou molécula. A massa molar é, em gramas, numericamente igual a massa atômica/molecular, sendo representado pela unidade g/mol.
Exemplos:
H2O = 18u = 18g/mol
C = 12u = 12g/mol
O2 = 32u = 32g/mol
Conhecer a massa molar de um elemento ou molécula é importante para realizar cálculos estequiométricos, determinar pureza de um reagente, rendimento de uma reação, entre outras aplicações.
Por exemplo, o número de mols de uma certa quantidade de uma substância pode ser determinada pela relação:
n = m/MM
Onde,
n é o número de mols, m é a massa da substância e MM é a sua massa molar
Por exemplo, quantos mols têm em 180g de água? (MMH2O = 18g/mol)
n = m / MM
n = 180g / 18g/mol
n = 10 mols
Leia mais em:
Como calcular a massa molar e massa molecular
Aula: Cálculo Estequiométrico – Massa
Mas quem foi que teve essa ideia de relacionar massa em gramas e massa atômica?
Foi Amedeo Avogadro (1776-1856), um físico e químico italiano, ele acreditava que a massa equivalente em gramas da massa atômica de um elemento iria possuir sempre o mesmo número de átomos.
Segundo Avogadro, 18g de água (18u) iriam possuir o mesmo número de átomos que 12g de carbono (12u) e assim sucessivamente. No entanto, infelizmente Avogadro faleceu antes de conseguir determinar que número fosse esse.
Porém, com os avanços tecnológicos do século XX, este número pode ser determinado e foi atribuído o nome de “Constante de Avogadro” em sua homenagem.
Leia mais em: O mol e a constante de Avogadro: Como fazer os cálculos
Uma dessas determinações experimentais do número de Avogadro foi realizada por Robert Millikan (1868-1953), num experimento que determinou a carga de 1 único elétron como 1,6 . 10-19C. Nesta época, a carga de 1mol de elétrons já era conhecida, com o valor de 96500C, podendo assim ser determinado o número de elétrons presentes em 1 mol pela seguinte relação:
Número de mol = 96500C / 1,6 . 10-19C
Número de mol = 6,03 . 1023 elétrons
Lembrando que o número de Avogadro representa um 1 mol de quaisquer partículas, sejam átomos, moléculas, íons, prótons, nêutrons e elétrons. Poderíamos utilizar o número de mols para representar objetos do dia a dia, no entanto, o número de Avogadro é da ordem de 1023 (603000000000000000000000 partículas), sendo um número ABSURDAMENTE grande, por isso, sendo apenas aplicado para partículas atômicas e subatômicas.
Por fim, a constante de Avogadro (NA), representada pela unidade mol, é uma das 7 unidades básicas do Sistema Internacional de Unidades (SI), utilizada para definir quantidade de matéria, sendo amplamente utilizada na química e na física.
Com os avanços tecnológicos novas casas decimais da constante de Avogadro vão sendo determinadas ao longo dos anos, a última atualização deste número ocorreu em 20 de maio de 2019, sendo considerado como oficial atualmente o valor de 6,022 14076 x 1023.
E ai Gás Nobre, bora exercitar?
Exercício:
Calcule o número de moléculas de CO2 presentes em um balão contendo 22g desse gás.
– Primeiro temos que calcular a massa molecular do CO2
As massas molares do C e do O são equivalentes em gramas a suas massas atômicas, ou seja, C = 12g/mol e O = 16g/mol
MMCO2 = 12 + (2×16)
MMCO2 = 12 + 32
MMCO2 = 44g/mol
– Pela relação [ n = m/MM ] podemos encontrar o número de mols de CO2
n = m / MM
n = 22g / 44g
n = 0,5mol
– Utilizando o número de Avogadro (NA = 6,022 x 1023) podemos determinar o número de moléculas presentes em 0,5mol desse gás.
Número de moléculas = n x NA
Número de moléculas = 0,5 x 6,022 x 1023
Número de moléculas = 3,011 x 1023,,
Gás Nobre, esses conceitos e cálculos são muito importantes pois são utilizados em diversos outros conteúdos da química, principalmente no cálculo estequiométrico que sempre cai no ENEM e demais vestibulares. Então bora treinar pra ficar ninja nesse assunto. Reage!
Leia mais em:
Aula: Introdução ao Cálculo Estequiométrico I
Aula: Introdução ao Cálculo Estequiométrico II
Gás Nobre! Você tem dificuldades para entender conteúdos de Ciências da Natureza? Não fique triste! Eu, professor Paulo Valim, quero te contar um segredinho que os melhores estudantes do Brasil já conhecem, com a minha plataforma Ciência em Ação, você vai conseguir aprender Química, Física e Biologia de forma rápida e efetiva e garantir a sua aprovação ainda em 2020.
Não importa se você tem dificuldades com as matérias ou se essa é a primeira vez que você vai estudar Química, Física ou Biologia. No Ciência em Ação, nossos cursos são completos e aprofundados. Eu e a minha equipe ensinamos todo o conteúdo do começo ao fim de forma didática.
Que foi? Você tem dúvidas de que o que eu estou falando é verdade? Então, saca só, Gás Nobre! Liberei o primeiro módulo completo da minha plataforma Ciência em Ação totalmente grátis pra você experimentar! Curtiu? Clique aqui e aproveite para conhecer a melhor plataforma de Ciências da Natureza da web!
Bora reagir e realizar os seus sonhos?
Me acompanhe nas redes sociais: curta a minha página no Facebook, siga o meu Instagram, se inscreva no canal do Youtube e entre no meu canal do Telegram.


